この記事は、前回に引き続き、下記のニュースを取り上げます。
田中耕一さんの技術、アルツハイマー早期診断への道開く:朝日新聞デジタル
アルツハイマー病の高精度アミロイドβ血漿バイオマーカー | Nature | Nature Research
さて、前回記事【「認知症」と「アルツハイマー病」って違うの?】では、アルツハイマー病と認知症の対比を通してまとめました。
特に以下の三点をおさらいしておきます。
・アルツハイマー病では「アミロイド」と「タウ」が脳に溜まる
・これが進行して脳機能が落ちると「アルツハイマー型認知症」になる
・「認知症」と「アルツハイマー病」は必ずしもピタリとは重ならない
厳密には「アミロイド」は「全てのアミロイドが悪い」わけではなく、「アルツハイマー病で溜まる特有のアミロイド」があるのですが、それは区別する必要が出てきた時に。
なお、今回は「検査」の話なので、「感度」と「特異度」という言葉が出てきます。
ゼロから説明すると記事が長くなってしまうので、とりあえず以下のように考えて下さい。
・感度:狙った病気があるときに、間違って陰性になりにくい
・特異度:狙った病気がないときに、間違って陽性になりにくい
感度・特異度は要望があったら別記事を立てます。とりあえず今回は省略で。
それでは本題に入りましょう。
こちらの論文を読み解いていこうと思います。
田中耕一氏の新技術が使われていることでも話題になった、「アルツハイマー病の新検査法」はどんなものなのでしょうか。
そして、それは既存の手法に比べてどんなスゴさがあるのでしょうか。
今回も「認知症疾患診療ガイドライン2017」をフル活用しております。引用はこまめに出典を付してはいますが、興味の湧いた方は実際にガイドラインを見てみたり、論文の方にも是非チャレンジしてみて下さい。

アルツハイマー病の検査にはどんなものがある?
アルツハイマー病Alzheimer’s diseaseの検査として現在実用化しているものをまとめます。
現在実用化されている検査を大きく分けると、次のようにまとめられるでしょう。
①病理診断
②臨床診断
③画像検査
④核医学検査
⑤髄液検査
さて、まずお話しするのは「過去の先人の蓄積」の解説です。
あんまり興味のない方は、次項「2.新しい検査はどんな方法?」まで読み飛ばして下さい。
病理診断
「病理」というのは、簡単に言えば「実際の脳組織を顕微鏡で見る」ということです。
これは元々のアルツハイマー氏がこの病気を見つけた「原点」であり、定義に最も忠実な診断法ですが、最大の欠点は「脳組織を取り出さなければ検査できない」こと。
つまりこの方法は、死んでから脳を取り出して初めて「あぁ、アルツハイマー病だったんだね」と分かるのです。
病理は絶対的な手法なので今も研究では使われますが、アルツハイマー病のような多くの脳疾患では生きている患者では調べられないというデメリットが大きな壁です。
臨床診断
これが現在最もメジャーな手法。「臨床診断」というと何やら仰々しいですが、簡単に言えば「患者の症状をよく分析すると、特別な検査をしなくてもある程度当たる」ということです。
前項を読んだ方は、「認知症は症状」「アルツハイマー病の本質は脳内のアミロイドとタウ」という話をご承知のことかと思います。この観点から言うと「症状で病気がわかる」のは不思議です。
しかし、実は「症状が特定の特徴を満たしていたら、このくらいの確率でアルツハイマー病」と予測できる診断基準があります。
(具体的な項目はガイドラインをどうぞ ※PDF直リンクです)
これは、「アルツハイマー病による認知症はこんな症状を出しやすい」という因果の糸を逆向きに辿って、間接的に「この認知症の原因がアルツハイマー病である確率が高い」と推定していることに相当します。
臨床診断で「アルツハイマー型認知症らしい」と判定された患者を病理で「答え合わせ」した研究を総合すると、感度81%・特異度70%くらいの精度と言われているようです。(McKhann, et al., 2011)
後述のような検査法が近年登場するまでは、臨床診断が唯一の「アルツハイマー病の生前診断」でしたし、現在もほとんどのクリニックではこの方法で診断が下されています。医師の適切な診療があれば特殊な設備などが無くても出来るわけですから、有用性は十分に高いと言えるでしょう。
ただし臨床診断は「認知症になってから」でないと十分な精度が出ないのです。「死後に診断が付く」のに比べれば「生きているうちに診断する」ことは意味がありますが、今後は「認知症になってから診断」よりも「認知症になる前に診断」することが重視される時代が来る可能性があります。これは治療の話に続きます。
画像検査
これはCTやMRIによって「脳の3D構造」を捉える検査。
アルツハイマー病になった脳の形が健康な人の脳とどう違うかを分析した研究はたくさんあります。
アルツハイマー病では内側側頭葉(「海馬」の周辺)の神経細胞が傷害を受けるので、その辺りの脳組織が萎縮します。感度85%・特異度88%と検出性能は比較的高い(Scheltens, et al., 2002)のですが、MRIは値段も非常に高いのがネックです。
核医学検査
「生きている患者の診断」としては「PIB-PET」が現時点で最高水準の検査です。
検査は、「放射性同位元素を埋め込んだアミロイドによく結合する化合物」を作り出し、患者に注入するというものです。物質の大半は普通に尿や便に混じってそのまま排出されていきますが、脳まで血流に乗っていったものが、そこでアミロイドに出会うと結合します。
脳にくっついたこの「特殊な物質」は、放射性同位元素の部分がゆっくりと放射線を放出しながら崩壊していくので、それをCTのような装置で検出できます。
「アミロイドに結合しなかった物質」は全て流れて体外に出ていくはずなので、「脳からこの放射線が検出できた」場合には、「アミロイドが溜まっている」と分かるんですね。
この検査は非常に感度が高く、病理診断との一致率は96%程度とも言われます。
さらにこの検査が優れているのは、「アミロイドの蓄積」が直接可視化できること。
つまり「認知症になる前にわかる」ということです。
「近い将来アルツハイマー型認知症になる高齢者」の95%はPIB-PETで事前に予測可能だという研究結果もあります(Benzinger, et al., 2013)。
また、臨床診断では「典型的でないアルツハイマー病に対応しにくい」という欠点がありました。すなわち「海馬付近で先に神経細胞が死んでいき、記憶症状が最初に出てくる」パターンを想定しているので、「海馬以外で多く神経細胞が死んでいき、最初に記憶障害以外の症状が出てくる」ような例外的な症例には対応できないのです。
PIB-PETでは、「普通と違う場所にアミロイドが溜まっている」場合でも、アミロイドの蓄積自体は問題なく検出されます。
「非典型的な場合こそ検査が必要とされる」ことを考えれば、これは重要なメリットです。
そんな強力な「PIB-PET」ですが、肝心の欠点は「設備と費用」です。
使う薬剤が非常に特殊で、しかも有効な時間が非常に短いので、これを病院でやるためには「病院の中にサイクロトロンを作る」必要があります。
設備投資・検査費用はここに列挙した検査の中でもぶっちぎりで高く、「この検査が保険適応にならないのは有効性が低いからではなく、医療財政が破綻するから」と言われるほど。
6桁レベルの医療費を全額自己負担で払おうという患者はそうそういません。
そのため、「最先端の研究」という位置付けでしか利用されていないのが現状です。
髄液検査
「アミロイドそのもの」を検出する別の方法が「髄液」です。長く言うと「脳脊髄液」。
そもそも「髄液とはなんぞや?」と言う話は、下の図を見ながらお話しましょう。
(下画像:地方独立行政法人大阪府立病院機構 大阪はびきの医療センターHPより引用)
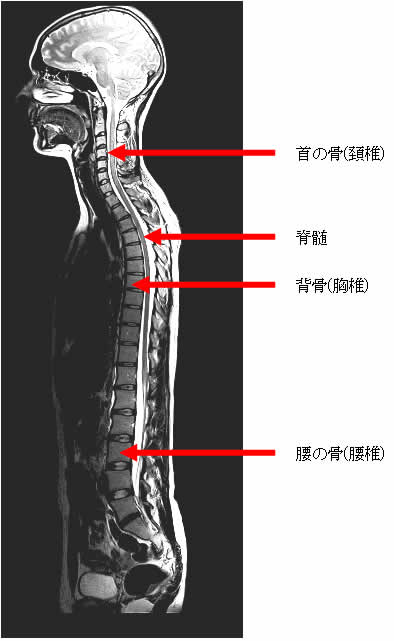
脳は「豆腐」みたいなものです。これを守るために「髄液」なる液体が頭蓋骨と脳の間を満たして、緩衝材のような役割を果たしつつ環流しています。この画像だと、脳は灰色っぽく、髄液は白く写ってます。
脳は脊髄に繋がって、細長く下に伸びていきますが、「髄液」も一緒に背骨に沿って下まで流れています。左の画像で、背骨の後ろ側に黒く縦に伸びる索状物と、その周りにある白い液体がそれです。
この図を見ると思いつくのが、「脳の中のアミロイドって、この髄液の中にも少しは溶け出してるんじゃないの?」「じゃあ背中から針で髄液を吸えばアミロイドが入ってるかわかるんじゃない?」という発想です。
安直な発想ではありますが、これが現在では微量のタンパク質を検出する「EIA法」によって実現されています。感度85%程度・特異度85%程度と言われています。
つまり、MRIと同程度の精度だということです。
設備投資を要するMRIと違って、「髄液だけ」を検査会社に送れば検査ができるので、小さな病院でも検査が行えるのがメリットです。検査会社が一括でたくさんの患者の髄液を検査しているため、今では検査費用も比較的安く済むようになっています。
ただし、低コストなのは「髄液の分析」であって、「髄液採取」は手軽には出来ません。そもそも「髄液を狙って針を刺す」ことがなかなか熟練を要する技術で、医師の中でも髄液を採取できる人間はごく一握りしかいません。「髄液の処理・検査」自体はハードルが低くても、「髄液の採取」のハードルが高いのです。
現状の検査の長所・短所
さて、長くなってしまいましたが、ここまでの話をまとめましょう。
| 検査法 | 安全 | 安価 | 手軽 | 早期診断 | 局在診断 | 感度 | 特異度 |
| 病理診断 | ― | × | ― | × | ◎ | ☆ | ☆ |
| 臨床診断 | ◎ | ◎ | ◎ | △ | △ | 81% | 70% |
| MRI | ○ | × | ○ | ○ | △ | 85% | 88% |
| PIB-PET | △ | × | × | ◎ | △~○ | ☆ | ☆ |
| 髄液検査 | △ | ○ | × | ○ | × | 85% | 83% |
病理診断は「絶対基準」として、他の検査の「答え合わせ」の位置付けになることが多いので便宜的に☆としました。100%だと思って下さい。
PIB-PETも近年では「答え合わせ」として使われることが多くなっているので、こちらも☆扱いにしました。(論文によっては、病理とPETの一致率は96%程度とも言われます)
新しい検査はどんな方法?
さて、ここまでの話を踏まえて、ようやくこちらの論文の手法を見てみましょう。
「髄液中の特定のタンパクを検出する」のも「血液中の特定のタンパクを検出する」のも、技術的には非常に似ています。
しかし、髄液に比べて血液では、以下のような困難があることが指摘されていました。
1.脳から血中へ放出される量が少ない
2.血中には大量のタンパクや脂質があり、これら莢雑物との結合が考えられる
3.血中のプロテアーゼ等で分解される
(樋口, BRAIN and NERVE-神経研究の進歩 Vol.69 No.7 より)
検出感度の問題点として、従来の髄液検査で主流だった「EIA法」では、どうしても十分な精度が出なかったようです。
ここを解決したのが、田中耕一氏率いる島津の研究チームでした。
島津のチームでは、「IP-MS (immunoprecipitation-mass spectrometry)」と名付けた、新たなタンパク質定量法を開発しました。これが従来のELISA法よりも高い精度でアミロイドを検出することに成功して、道が拓けたとのことです。
更に、よくよく読んでみると、この「IP-MS」の他にもいくつかの工夫が見受けられます。
実はアミロイドにはいくつかの種類があり、「Aβ1-40」「Aβ1-42」といった名前がつけられています。このうち、「Aβ1-42」が「アルツハイマー病で溜まってくるアミロイド」として知られていました。
「Aβ1-40」「Aβ1-42」は従来から注目されており、この比を見るという手法も考案されていましたが、当該研究ではこれに加え「APP669-711」という物質にも着目しています。
何だか難しい名前ですが、実はこれ全て「同じタンパク質が分解されて生じる別の形の断片」なのです。論文の図を単純化したものを下に示します。
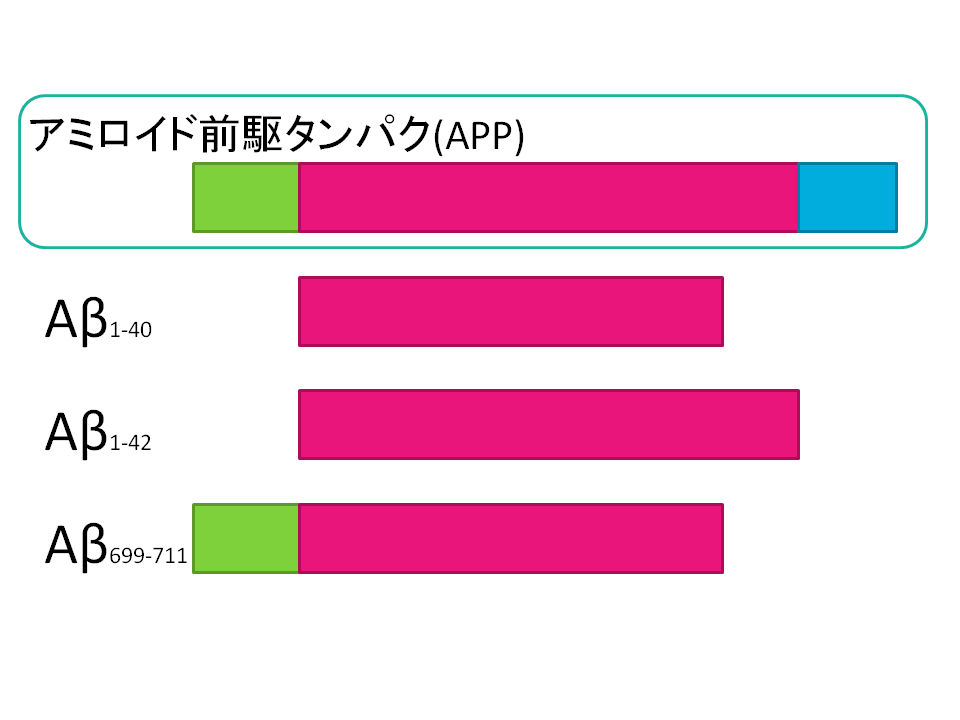
で、面白いことに、「髄液の中にAβ1-42が多いか少ないか」を調べるだけだと「実際に脳にアミロイドの沈着が多いか少ないか」の予測には精度不十分だったことが分かります。これを補正するために、「Aβ1-42の量が”Aβ1-40やAPP669-711に比べて”多いか少ないか」を数値化したところ、「実際の脳のアミロイド沈着」とかなり一致した、というのです。
この「Aβ1-42をAβ1-40やAPP669-711に対する相対的な量で判定する」という手法は髄液でも確立されていなかった方法です。
新しい検査の性能は?
脳に近いのは血液よりも髄液なので、普通に考えたら髄液検査の方が血液検査よりも精度が良くなりそうなものですが、なんと当該論文では過去に報告されている髄液検査と同等かそれ以上の検査精度を示していました。
おそらく、上項で紹介した「3種の物質の量から判定する」方法が有効だったのでしょう。
「1.アルツハイマー病の検査にはどんなものがある?」で提示した表に今回の論文で提起された検査を加えるなら、このようになります。
| 検査法 | 安全 | 安価 | 手軽 | 早期診断 | 局在診断 | 感度 | 特異度 |
| 病理診断 | ― | × | ― | × | ◎ | ☆ | ☆ |
| 臨床診断 | ◎ | ◎ | ◎ | △ | △ | 81% | 70% |
| MRI | ○ | × | ○ | ○ | △ | 85% | 88% |
| PIB-PET | △ | × | × | ◎ | △~○ | ☆ | ☆ |
| 髄液検査 | △ | ○ | × | ○ | × | 85% | 83% |
| 新血液検査 | ○ | ? | ○ | ○ | × | 92% | 82% |
新しい検査の「費用」はまだ評価不能なので「?」としましたが、髄液検査と同程度まで安価になる可能性は十分にありますね。
さて、この表を見て、今後の診断がどういう位置づけになるか考えてみます。
臨床診断の重要性は今後も失われることはないでしょう。アルツハイマー病は高齢者で非常に頻度の高い病気ですから、実際に全員に検査を行うのは現実的ではありません。
また、確定診断となる「病理診断」と「PIB-PET」も、研究を中心に今後使われ続けるでしょう。
問題は「スクリーニング」のあり方です。
アルツハイマー病の検査はいずれもハードルが高いため、現在はごく一部の、非典型的な患者や若年性認知症の患者でしか検査は行われていません。しかしここに、「採血で、髄液検査とほぼ同等の精度の検査」が加わったら話が変わってきます。
「髄液採取」を行えるのは医師のごく一部、「MRI」や「PET」を行えるのは病院のごく一部。しかし「採血」なら、医師どころか全ての看護師・検査技師が全ての病院で実施可能なはずです。
「血液検体だけを検査会社に送って、化学的な処理や検出は一括で行う」ようにすれば、事実上「あらゆる病院・診療所でアルツハイマー病の検査が可能」になるわけです。
「採血」という手軽さと、「症状が出る前に分かる」という早期診断性能によって、この技術が今後のアルツハイマー病の診療スタンスを変える可能性は大いにあると思います。
髄液検査や核医学検査を全ての人が2,3年に1回受けるなんて現実的ではありませんが、採血だったら健康診断で毎年やっていますし、そこに項目を一つ増やすことだけなら実現可能性の高い話です。
アルツハイマー病は現在も非常に精力的な研究が行われていますが、今に至るまで根本的な治療薬はありません。
そもそも、神経細胞は死んだらほとんど蘇らないし、死んだ神経細胞が再び増えたところで記憶は蘇らないのですから。アルツハイマー病を「元に戻す」ことは原理的に不可能なのです。
現在のアルツハイマー病治療の研究では、「アルツハイマー病だけどまだ認知症になっていない患者」を見つけて、「認知症発症まで進行するのを阻止する」方法が最も実現可能性が高いと言われています。
一例ですが、高血圧や糖尿病は健康診断で早めに発見されるようになってから、「脳出血や心筋梗塞を起こす前に予防しましょうね」と言われる時代になっています。
これと同じように、
「50歳を過ぎたら健康診断のついでに、3年に1回はアルツハイマー病の検査もどうですか?」
「アルツハイマー病が始まっています、認知症にならないように進行抑制の薬を使いましょう」
と言われる時代が来るのでは……と、私は妄想しています。
近年は医療技術の進歩に対しても、「寿命だけ伸ばしてどうするんだ」「大事なのは健康寿命だ」という主張が増えてきました。
現代の流れにおいて、この「アルツハイマー病が認知症になる前に手を打とう」という研究は、この点からも社会の要望を叶えうる技術であります。
今後も需要が高まるアルツハイマー病治療。その介入において、「採血での判定」という革新は、認知症の診療体系そのものに影響を与える可能性がある、と個人的には感じました。
★ひとことまとめ
現状の検査は「設備の必要な画像検査」か「技術の必要な髄液検査」
血液検査で髄液検査より高精度でアルツハイマー病を検出できそう
アルツハイマー病研究は「早期診断・発症予防」の時代が来そう
☆このトピックにオススメの本
臨床で役立つ! ゼロから学ぶ 医学統計.
ナツメ社, 2016/3/14
新しい検査の「性能」を定量的に評価するためには、統計の知識が必要となります。
元の論文ではROC曲線も図示されていますが、そこまで踏み込むと記事がやや煩雑になるため今回の記事では省略しました。私が見た範囲で「感度・特異度」も「ROC曲線」も扱っていて最も分かりやすいのがこの本だったので紹介しておきます。
本書を一読すれば、原著の論文で使われている統計的な比較も一通り意味が分かるはずです。
飯島 裕一, 佐古 泰司:
認知症の正体 診断・予防・治療の最前線.
PHPサイエンス・ワールド新書, 2011/5/21
認知症の治療・検査について触れています。また、認知症疾患を「アルツハイマー病」「前頭側頭型認知症」「レビー小体型認知症」など種別にキチンと分けて解説している科学的な解説書です。
アルツハイマー病の病理標本やアミロイドとの関係も説明されており、本記事や前回記事の内容をもっと詳しく知りたい方にはオススメです。
参考文献
ガイドライン・レビュー
(監修)日本神経学会, (編集)「認知症疾患診療ガイドライン」作成委員会 : 認知症疾患治療ガイドライン. 医学書院, 2017
Association As (2017) 2017 Alzheimer’s disease facts and figures. Alzheimer’s & Dementia 13: 325-373.
書籍
BRAIN and NERVE-神経研究の進歩 Vol.69 No.7 増大特集 あしたのアルツハイマー病治療
論文
この記事を書いた人
狐太郎
最新記事 by 狐太郎 (全て見る)
- AIサービスを活用した英文メール高速作成術 - 2023年3月28日
- 大学生・院生に便利なAIウェブサービスまとめ【2023年2月版】 - 2023年2月22日
- 「読書強者」が「速読」に価値を見出さない理由【隙間リサーチ】 - 2022年9月23日







